一、結構決定性質
“結構決定性質”,有些物質雖然都是由同樣的元素構成,但是內部結構不同,性質就大相徑庭。通俗點說,同樣一群人,排不同的陣勢去打仗,發揮的效果是不一樣的。
碳元素是個大家庭,有眾多同素異構體。雖然都由碳原子構成,但由于擁有各種不同的分子晶體結構,所以它們的物理性質截然不同,差別極大。比如,以最普通的成員金剛石及石墨為例,它們的許多物理性質分別位于兩個極端:石墨性軟,鉆石卻是最硬的礦石。石墨是良導體,鉆石是絕緣體。石墨烏黑不透明,鉆石晶瑩剔透閃亮光。石墨極為普通隨處可見,鉆石卻是價值昂貴的珠寶。
碳的同素異構體中,石墨是碳原子以SP2雜化軌道相互成鍵的,SP2雜化軌道的成鍵特征,決定了石墨是一種平面六方的層狀結構。由于層間靠較弱的范德華力結合,所以層與層之間很容易滑移。這種性質使石墨可用于潤滑劑和鉛筆芯之中。此外,原子層之間較弱的范德華鍵也讓一些電子可以沿層面自由流動,使石墨成為良好的導電體。

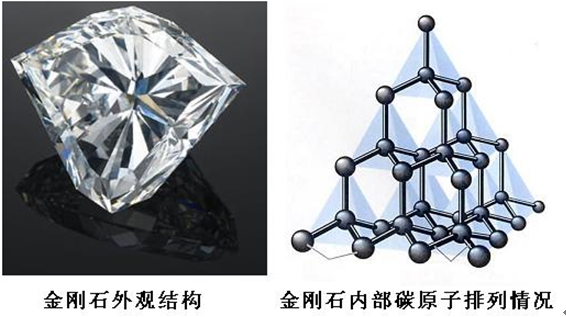
金剛石是碳原子以SP3雜化軌道形成的正四面體結構,是由具有飽和性和方向性的共價鍵結合起來的晶體。硬度、熔點、耐磨性都極高,而且不導電。
碳的其他同素異形體結構,還有石墨烯、碳納米管、富勒烯(C60)等,基本上都以類似的平面正六邊形結構為主,有時也混雜了一些五邊形和七邊形。這些不同結構各有特點,如果忽略很小的納米尺度,從幾何維數來分類,可以將碳納米管看成是1維結構,石墨烯是2維結構,富勒烯則可以算是點狀的0維結構,最典型的富勒烯是擁有60個碳原子的巴克球C60,其結構與一個現代足球類似。


二、碳家族來了新成員
在富勒烯(C60)的基礎上,科學家們還研發了兩種不同形態的金剛石:非晶態金剛石和次晶態金剛石,這兩種結構既保留了金剛石的硬度,又改善了原始金剛石的脆性,有著更強大的力學性質和熱穩定性。該研究成果曾在線發表于權威學術期刊《自然》雜志上。
次晶態金剛石的合成除了填補理論上的空白,更具備廣泛的應用價值。它除了具有和普通晶體金剛石相當的力學性能以外,還有非常獨特的可調節的光學性能。“這意味著次晶態金剛石可能會是一個極端條件下非常良好的窗口材料。”由于次晶態金剛石具有非常寬的熒光峰和較高的熱穩定性,預期未來將在包括生物醫學等在內的多個領域產生更加廣泛的應用。
另一個新成員非晶態金剛石結構中,SP3碳的比例可以達到97.1%。這種新型材料的硬度與抵抗形變的能力與天然金剛石相當,是已有的非晶質材料中硬度、熱導率最高的。
這兩項研究不僅為龐大的碳家族添加了兩個全新的成員,還為更多應用提供了可能性。相比于常規的晶體金剛石,次晶態與非晶態的金剛石有著更突出的力學性質。此外,它們的熱穩定性也更優越,因此在精細加工和一些極端環境中或將擁有廣闊的應用前景。

碳材料幾乎包括了地球上所有物質所具有的的性質。在科學家們的探索中,還有很多新型碳材料在不斷發現中。可以說沒有哪種元素能像碳這樣,作為單一元素可形成如此之多的結構和性質完全不同的物質。這也正是碳元素的魅力所在!


 手機資訊
手機資訊 官方微信
官方微信










 豫公網安備41019702003646號
豫公網安備41019702003646號